超精密加工・バイオ工学がゲノム研究を助ける―微生物1細胞ゲノム解析用「AGM™試薬キット」の開発について
本記事の内容は、発行日現在の情報です。
製品名や組織名など最新情報と異なる場合がございますので、あらかじめご了承ください。
PDFダウンロード
PDFをダウンロードいただくには、会員登録が必要です
- 目次

東陽テクニカは、国立研究開発法人理化学研究所(以下 理研)が研究開発した、AGM(アガロースゲル・マイクロカプセル)の作製技術について、同研究所と所有特許(特許第 7018685 号)などに関する使用許諾契約を2022年9月に締結し、微生物1細胞(シングルセル)ゲノム解析用として、「AGM™試薬キット」を2023年1月より販売します。
そのAGMの開発者である理研 光量子工学研究センター 先端光学素子開発チームのチームリーダー山形豊氏と、研究員の青木弘良氏にお話を伺いました。
「AGM™試薬キット」は超精密加工とバイオ工学が組み合わさることで生まれた、1細胞ゲノム解析の可能性を広げるツールです。マイクロ流路からの発展や昨今のゲノム解析の手法について触れ、今後の「AGM™試薬キット」の発展についてもお話しいただきました。

【インタビュアー】
小森 研治
(株式会社東陽テクニカ ワン・テクノロジーズ・カンパニー インキュベーションユニット 課長)
「AGM™試薬キット」の概要から、山形氏・青木氏の専門、前提知識としてのマイクロ流路

左:山形 豊氏/右:青木 弘良氏
「AGM™試薬キット」の概要について、AGM開発者として簡単にご説明いただけますか。
私たちの環境にはさまざまな微生物が存在していますが、それらのほとんど(99%)は培養できず、その機能はこれまで未知でした。近年、環境試料を直接抽出し、その中の遺伝情報であるゲノムDNAを分析するメタゲノム解析が行われ、徐々に環境中の微生物が解明されつつあります。
しかし、メタゲノム解析では集団のゲノムDNAを解析するため、別々の微生物のDNAを誤って一つと見なしてしまうことや、環境にわずかしか存在しない微生物の解析は困難、といった課題があります。
このメタゲノム解析の補完的な手法として、1細胞(シングルセル)ゲノム解析が行われます。1細胞ゲノム解析では微生物を単離後、ゲノムDNAを酵素で増幅して解析し、より高精度なゲノム解析が可能となります。
ただし1細胞ゲノム解析には、ゲノムDNAの酵素増幅反応において、局所的なDNA増幅(増幅バイアス)により、全体のゲノム情報を得るのが困難という課題があります。
増幅バイアス抑制には、反応量を従来の1/1,000以下(0.0001 mL以下)にする微量化が有効ですが、そのような反応容器は市販されておらず、作製も困難です。そのため微生物の研究者が、容易に実験できる、微量反応容器が求められていました。
そこで開発が進められ、1細胞ゲノム解析の課題を解決したものが「AGM™試薬キット」です。
今回発表した論文1)では、1細胞ゲノム解析における課題に対し、簡便な解決策として、AGMを提案しました。論文では、作製方法の確立と、(1)大腸菌、(2)ヒト腸内細菌叢モデルとしての細菌混合物、および(3)環境試料として、シロアリ腸内細菌を用いた、実証実験を行いました。
その結果AGMを用いて増幅バイアスを抑制し、従来よりも均一で高品質な増幅DNAが得られ、簡便で実用的な1細胞ゲノム解析を確立しました。
1) Aoki H, Yuki M, Shimizu M, Hongoh Y, Ohkuma M, Yamagata Y: Agarose gel microcapsules enable easy-to-prepare, picolitre-scale, single-cell genomics, yielding high-coverage genome sequences. Sci. Rep., 12, 17014 (2022).
山形先生、青木先生のご研究テーマについて教えていただけますか。

山形氏:先端光学素子開発チームおよび理研のマシンショップである技術基盤支援チームのチームリーダーを務めており、光学素子や微細構造物の超精密加工を専門としています。一般的な非球面レンズ2)のみならず中性子線やX線の光学素子3)の研究開発も手掛ける傍ら、バイオ工学への応用も進めています。
2) 一般的なレンズは、ガラス研磨で作製され、球面から構成されるため、光を完全に一点に収束できない。これに対し非球面レンズは、精密金型によるガラス成形で作製され、非球面形状による、一点への集光可能な高性能のレンズである。近年デジタルカメラやスマートフォンに用いられ、カメラの小型化や高性能化に貢献している。
3) 原子炉や加速器から出てくる、中性子やX線を反射して集光する超高精度なミラー。超精密加工技術で作られ、その表面は0.1 nm (約100億分の1メートル)級の滑らかさをもつ。

青木氏:大学では農芸化学を専攻し、大学院ではデンプンなど多糖を分解して、甘味料を作る酵素の研究をしていました。その後は稲のゲノム解析、マイクロ流路を使った測定系の開発、ナノ繊維を使った細胞培養などを行いました。現在はバイオ工学が専門です。
山形氏:青木さんのように、生物学のバックグラウンドを持ちながら、装置やエンジニアリングに興味を持って取り組む研究者は貴重だと思っています。
マイクロ流路について用途などを詳しく教えてください。
マイクロ流路は、数cm角の透明なシリコーンゴム製のチップ内部に50 μm~100 μm (μm: ミクロン、0.001 mm) ほどの、髪の毛の太さくらいの微細な溝を形成した、分析用デバイスです。半導体製造技術(MEMS技術)を用いて作製され、2000年頃から、マイクロ流路デバイスについて、開発を行っています。
実験といえば昔は100 mLなど大きなビーカーでしていたのですが、最近では液量がだんだん小さくなってチューブやマイクロプレートなど、10–50 μL(μL: マイクロリットル、0.001 mL)ほどになってきています。
マイクロ流路は、さらにサンプルが数μLと微少で済み、検出装置に組み込みやすいことから、微小な空間における化学反応の分析や、微量検体の生化学分析、疾患の検出、および細胞の遺伝子解析など、化学・生化学・生物学など幅広い分野で研究されています。
AGM開発のきっかけ、現在に至るまでの道のり
AGMを発明するきっかけは何だったのでしょうか。先生方の研究のキーワードは「ゲノム解析」「1 細胞」「微生物」などのAGMの関連キーワードに一見つながらない感じがいたします。
山形氏:きっかけは、私が理研に入所した当時の上司である牧野内昭武先生の言葉、「生物系と関わりを持てる研究テーマを探しなさい」というものです。
牧野内先生は紫綬褒章も受章されたとても有名な先生で、専門分野は主にモノづくりのための計算機によるシミュレーション技術の開発で、VCAD(ボリュームCAD)システム4)の研究をされていました。先生の研究室は、理研の半分以上を占める生物系の研究者との接点が少なく、それがこの言葉につながっていたと思います。
以降、「何か生物系に関連のあることはできないか」と考えていたところ、理研 バイオリソース研究センター(BRC)5)微生物材料開発室室長の大熊盛也先生から、マイクロ流路を使った1細胞ゲノム解析のお話を受けたことがAGM開発のきっかけとなります。10年ほど前の話です。
4) 理研で2001年から10年間にわたって開発された、モノづくりを支援するための設計、計測、画像処理、モデル化、シミュレーション、可視化、加工を統合することを意図した新しいシステム。
5) 実験動物や微生物の遺伝子をコレクションして維持している機関。国内外の研究機関や製薬企業などに、実験試料を配布する役割を持っている。微生物材料開発室はBRCのなかで微生物を担当している。
当時、大熊先生はシロアリ腸内の、原生生物共生細菌の研究をされていました。シロアリ腸内に生育する原生生物(単細胞性の真核生物)には、細胞内外にさまざまな細菌が生育し、セルロース分解や栄養成分の交換を通じ、共生関係を形成しています。
これら共生細菌は実験室での培養が困難なため、共生関係の解明には、マイクロマニピュレータ6)で単離後、1細胞ゲノム解析による機能の推定が重要です。しかし従来の方法では、増幅バイアスによって、局所的なゲノム情報しか得られません。
6) 顕微鏡、微細なガラス管、ガラス管に接続された小型注射器状のポンプ、およびガラス管位置合わせ用の三軸ステージ、から構成される装置。ディッシュ上に散布した微細な細菌や細胞を、顕微鏡で観察しながらガラス管で吸引し、別のディッシュや容器に吐出して、単離できる。
そこで最初マイクロ流路を用いて、細菌を流路内の反応チャンバーに単離し、ゲノム増幅するデバイスを検討しました。しかし単離したサンプル数に応じて反応用チャンバーを作る必要があり、チャンバー数に応じて、マイクロ流路が複雑になる課題がありました。また実験間の微生物やDNAの混入を防ぐために、労力をかけて作製したマイクロ流路を、実験終了後破棄しなければいけないといった問題がありました。

超精密加工機 ULG-100A(H3)(芝浦機械製)
4軸制御で超精密加工が可能。100 nm以下の精度を誇る
AGMの発想にたどり着いたのはどのような経緯ですか。
6年ほど前、マイクロ流路による単離に限界を感じた後、アガロース7)のゲルフィルム内に細菌を包埋した後、レーザーで切り出し、酵素ゲノムDNA増幅を行う方法を考えました。しかしレーザーでの切り出しは確実ではあるが手間がかかり、また増幅DNAの拡散が細胞周囲に限られ、解析に充分な量が得られません。
7) 海藻から得られる寒天を、高度に精製したもの。透明で、加熱により溶解し、冷却により凝固(ゲル化)するため、バイオ実験の分析などに使用される。
ゲノムDNAの酵素増幅では、樹状の高分子量増幅DNAが得られます。そこで内部が液状で、外側が試薬を透過し、細菌や高分子量の増幅DNAを保持するゲルから構成された、マイクロカプセルなら、単離も容易で、解析に充分な量が得られるのでは、と考えました。
特に、微生物の研究者であっても作製しやすく、使いやすいシンプルなキットを設計したいと考えていたことから、複雑な流路を用いずに、実験室にある使い捨てのプラスチック製の容器と装置で作製できる方法を確立しました。結果、1細胞を包埋する数十万個のカプセルが、一度の工程でできるようになりました。
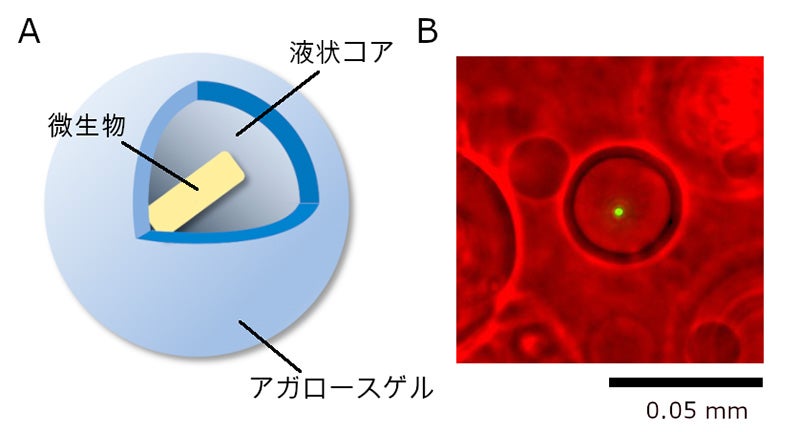
図1:AGMイメージ(理研提供)
A:AGMの模式図。解析対象の微生物が含まれた液状コアを、アガロースゲルで覆っている。
B:AGMの顕微鏡像。緑は大腸菌。
開発において難しかったことは何ですか。

構造を思いついてからは、140回ほどの試行錯誤がありました。難しかったことは、安定的にゲルの外膜を作ることです。
AGMを作る工程自体は簡単で、アルギン酸8)のゲルビーズを作った後に、加熱したアガロースと混和します。次にこれをオイルに懸濁してエマルジョンにし、冷却によりアガロースをゲル化して、カプセルを形成します。このようにゲルビーズの周りがアガロースに覆われることでカプセルができるのですが、何も処理をしなければカプセルが沈降し、お互いにくっついてしまいます。そこでカプセルを均一に分散させるために、比重の重いオイルを使うことで解決しました。
8) 海藻から得られる成分で、カルシウムによって透明なゲルを形成し、カルシウムの除去により液状化(ゾル化)する。
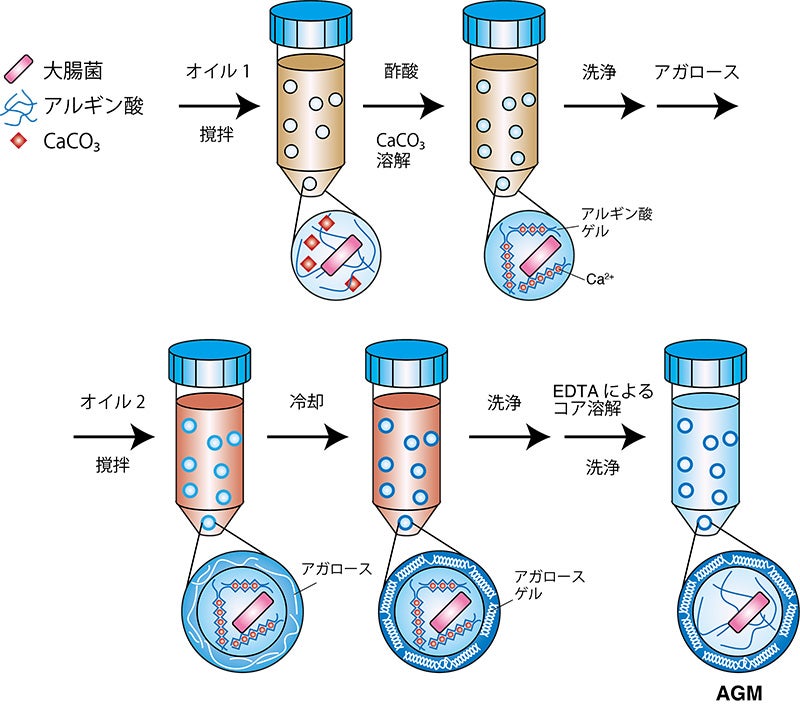
図2:AGM作製手順(理研提供)
AGMの今後の応用について
今後、AGMのヒトへの応用の可能性に関してお聞かせいただけますか。
ヒトの微生物や腸内細菌などの解析から、健康や医療につなげられると考えています。またヒトへの応用については、ヒト細胞を使った1細胞ゲノム解析にも、役立てることができるでしょう。
医療に関しては、妊娠されている方の胎児由来の細胞を単離して解析できれば、母体に負担の少ない出生前診断への応用や、がんの診断に応用できる可能性があります。がんは、1mmくらいのがん組織からでも血液を循環するがん細胞が発生するので、そういった微量ながん細胞を捉えてゲノム解析ができれば、がんの早期診断や治療予後の判定に役立ちます。
このようにAGMは、被験者の負担が少ない、1細胞ゲノム診断に応用できると考えています。

AGMを作製している様子
DNAの混入を防ぐため、内部が清浄に保たれた安全キャビネット内で実験を行う
今後の「AGM™試薬キット」を起点にした周辺技術に関する開発テーマはありますか。
現状のAGMは微生物を対象にしたキットになっているため、ヒト細胞を使ったゲノム解析や発現遺伝子解析のための試薬を作ることですね。
また、AGMに求めるサイズは研究者によって異なるので、均一なサイズを求める研究者のためにAGMを作るためのマイクロ流路の開発を考えています。この場合はより定量的な発現遺伝子の量を調べることも必要になるかと思いますので、その対応も考えています。
1細胞ゲノム解析に関しては、多数のAGMの中から、目的の増幅DNAを含むAGMを単離する自動装置が必要です。従来技術のFACS(蛍光セルソーター)は、ヒト細胞を単離するために開発された装置ですが、ヒト細胞よりも大きなAGMには応用できませんでした。現状手作業によりAGMを単離していますが、これを自動化することにより、作業の効率化を図ります。
またこのような装置は、細胞が大きくFACSでは単離困難な、生殖医療に用いられる卵母細胞や受精卵の単離にも、貢献できると期待されます。
AGM開発を実現させたモットー

開発者として大事にしていること、また、若い研究者に向けてのメッセージをいただけますか。
山形氏:人がやっていない分野をやっていくことがポリシーですね。たくさんの人が取り組んでいる分野には手を出しません。皆がやっている分野は食い尽くされてなくなります。若い人は前例のない仕事をやりたがらない人が多い印象ですが、ぜひチャレンジをしてほしいです。勇気も要るし変わり者扱いされることも多いですが、とても大事なことだと思います。
青木氏:大学卒業後に稲ゲノム解析に従事した際、使用していたアプライド・バイオシステムズ社の370A DNAシーケンサーの、開発資料を読む機会がありました。この装置は、1986年カルフォルニア工科大のリロイ・フッド先生の研究室で開発された、初期のDNA解析装置です。現在の装置より解析能は落ちますが、当時は主流の装置で、稲以外にも、ヒトゲノム解析など大規模ゲノムプロジェクトに貢献しました。
その資料で、普段使用している装置が、どのような仕組みで動作して、分析し、ユーザーにデータを提示するか学び、おもしろいと感じました。
もともと物理や電気、ソフトウェアといった分野は苦手だったのですが、自分が苦手な分野であっても、少しでも面白いと思う部分があれば、人間は挑戦できると思います。自分が面白いと思った気持ちを、大切にしてください。
また、今回のAGM開発は1人ではできませんでした。他分野の専門家、特許など知財関係の方々、研究資金のサポートなど、いろんな人がいなければできなかったと強く思います。1人で悩むよりもいろんな人に相談して、周囲の協力を得ながら、仕事をすることが大切だと感じます。
おわりに
理研は他分野の研究者と気軽に話ができる環境であることが良いところ、と山形氏は語ります。AGM開発においても、当時近くで研究をしていた大熊氏が「こんな物を作ってほしいけど、そちらでなんとかならないか?」と山形氏に話しかけたことで始まりました。
超精密加工・生物学・工学といった専門分野が融合することで、理研の風通しの良い環境だからこそ生まれた「AGM™試薬キット」。これからのゲノム解析や生物学全般だけでなく、医療への応用についても期待が膨らむお話でした。



